PRE-REQUIS ET DEMARCHE D’EVALUATION DU RISQUE selon l’ANSM décembre 2008
Contexte
L’exposition volontaire de l’homme à des substances chimiques, afin d’en déterminer le potentiel de sensibilisation, n’est plus acceptable. Néanmoins, la mise en place d’un test clinique final de sécurité (TCFS) chez l’Homme, afin de confirmer en tout dernier ressort l’innocuité d’un produit cosmétique, est envisageable.
Cette exposition volontaire ne peut se faire que si un processus préalable d’évaluation du risque a été conduit en accord avec les normes actuelles de la toxicologie. Il s’agit notamment d’évaluer individuellement les différentes substances du produit (données toxicologiques, données physico-chimiques, taux de pureté, taux d’impureté, type d’impureté, stabilité, qualité, données bibliographiques …), de déterminer, dans la mesure du possible, des valeurs toxicologiques de référence, puis de mener une évaluation quantitative du risque prenant en compte le potentiel, l’exposition et les différents facteurs de sécurité.
Pour des raisons historiques, tenant aux limitations des tests réglementaires définis par la recommandation OCDE 406 [1], les aspects quantitatifs n’ont pas été pris en compte dans l’évaluation du risque de sensibilisation. Le développement et la validation du Local Lymph Node Assay (LLNA [2]) comme test réglementaire (recommandation OCDE 429) et la définition de la valeur de l’EC3 a permis la définition de seuils de sensibilisation.
À partir de la valeur de l’EC3, il est possible de proposer une valeur du NESIL (Non Expected Sensitization Induction Level) qui représente, pour la sensibilisation, l’équivalent de la valeur du NOAEL (Non Observed Adverse Effect Level) généralement utilisé en toxicologie. Il est actuellement admis que cette valeur doit être exprimée en dose par unité de surface [3]. Une démarche d’évaluation quantitative pourrait éventuellement reposer sur les données issues du LLNA, quand la réalisation de ce test est possible.
Démarche d’évaluation pour un produit cosmétique
Avant la réalisation d’un test clinique final de sécurité, une évaluation des risques de sensibilisation doit être effectuée. Il est de la responsabilité de l’industriel de justifier qu’aucune substance sensibilisante n’est utilisée dans des conditions (concentration, système formulatoire…) pouvant potentiellement présenter un risque allergisant dans les conditions de l’étude. A ce stade, il convient d’introduire une différence entre les substances « historiques » et les « nouvelles » substances.
a) Pour les substances historiques, il appartient à l’industriel de disposer de tous les éléments garantissant l’absence de potentiel sensibilisant aux concentrations et dans la formulation proposée. Les substances présentant un potentiel sensibilisant, établi par des études expérimentales et/ou d’usage, doivent faire l’objet d’un examen particulier justifiant que leur dose dans la formulation ne présente pas de risque de sensibilisation prévisible. Les données bibliographiques ou toutes autres données pertinentes disponibles permettant d’étayer la démarche devront être mises à jour.
b) Pour les nouvelles substances, une démarche d’évaluation complète devra être menée, démontrant l’absence de risque de sensibilisation (potentiel sensibilisant nul ou niveau d’exposition insuffisant pour induire un risque de sensibilisation). Bien que non applicable à toutes les substances, l’outil le plus pertinent permettant l’estimation des seuils de sensibilisation reste, en l’état actuel des connaissances, le modèle « Quantitative Risk assessment » (QRA) [4], associé au test LLNA.
PROTOCOLE et METHODOLOGIE DU TCFS
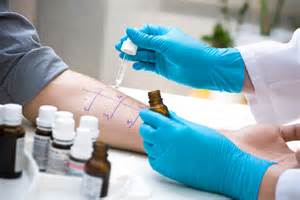
L’objectif principal de cet essai clinique est de confirmer que l’application réitérée d’un produit cosmétique dans des conditions d’utilisation maximalisées, chez des volontaires sains, n’entraîne pas de réactions d’allergie de contact retardée.
Les objectifs secondaires sont d’évaluer la compatibilité cutanée (irritation) du produit d’une part après
application cutanée unique et d’autre part après utilisation réitérée.
…/….







 Follow us on Linkedin!
Follow us on Linkedin!